En l'objectiu 4 hem aprés les tres lleis dels gasos i com resoldre exercicis matemàtics d'aquestes lleis.
Les lleis dels gasos en expliquen que relacionen les magnituds pressió, volum i temperatura del gas i que en cada llei es fixa una d'aquestes magnituds i s'estudia com varien les altres.
4.1 Llei de Boyle
Les lleis dels gasos en expliquen que relacionen les magnituds pressió, volum i temperatura del gas i que en cada llei es fixa una d'aquestes magnituds i s'estudia com varien les altres.
4.1 Llei de Boyle
En aquesta llei varia la pressió i el volum quan la temperatura es constant. S'aplica sols als gasos.
La pressió i el volum són inversament proporcionals això implica que si una magnitud es multiplica per un número, l'altra magnitud es divideix pel mateix número.
Si es fa un experiment a temperatura constant i es representa la pressió davant el volum s'obté:
Si es fa un experiment a temperatura constant i es representa la pressió davant el volum s'obté:
T=K
P1·V1=P2·V2
Per a la pressió i volum es pot utilitzar qualsevol unitat.
Desde el punt de vista de la teoria cinètica sabem que la velocitat de les partícules és constant, perquè així es la temperatura, però quan el volum que ocupa el gas és més xicotet, les partícules xoquen més vegades contra les seues limitacions i quan el volum és més gran, com la velocitat de les partícules és la mateixa que abans, aquestes xoquen menys vegades contra les parets.
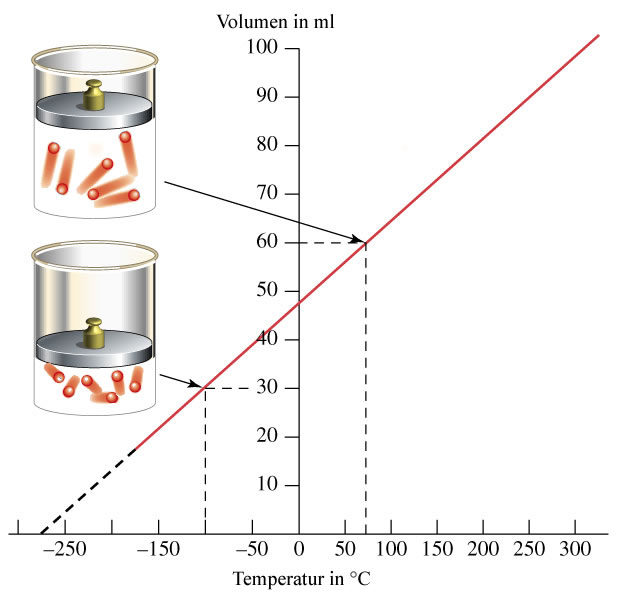
4.2 Llei de Charles
En aquesta llei varia el volum i la temperatura, la pressió es fixa. S'aplica també als gasos.
La temperatura i el volum són directament proporcionals, això vol dir que si alguna de les dos magnituds augmenta, l'altra també i amb la mateixa mesura.
Si es fa un experiment a pressió fixa i es representa la temperatura davant el volum s'obté:
L'expressió matemàtica de la llei és:
FORMULA
V/T=K
V1/T1=V2/T2
Per al volum podem utilitzar qualsevol unitat i per a la temperatura kelvin (encara que en la grafica gaste els ºC).
Desde el punt de vista de la teoria cinètica si la pressió és fixa, es a dir, que el nombre de xocs contra les parets siga durant un cert temps el mateix, si el volum que ocupa el gas augmenta, les partícules han d'anar més ràpides, pel que la temperatura augmentarà. Si el volum disminueix les partícules aniran més lentes i la temperatura disminuirà.
4.3 Llei de Gay-Lussac
En aquesta llei la pressió i la temperatura varien i el volum es fix. S'aplica als gasos.
La temperatura i la pressió són magnituds directament proporcionals, si alguna de les dos augmenta o disminueix, l'altra farà exactament el mateix.
Si es fa un experiment a volum fix i es representa la pressió davant la temperatura s'obté:
Si es fa un experiment a volum fix i es representa la pressió davant la temperatura s'obté:
T/P=K
P1/T1=P2/T2
En la pressió s'utilitza qualsevol unitat, els kelvin per a la temperatura (encara que en la gràfica gaste els celcius).
Desde el punt de vista de la teoria cinètica quan la temperatura del gas augmenta, les molècules del gas es mouen més ràpidament i, per tant, augmenta el nombre de xocs contra les parets del recipient que les conté. Augmenta la pressió perquè el seu volum no pot canviar.
4.4 Exercicis matemàtics sobre les lleis dels gasos.
He refet un exercici de cada llei per repassar, i no he tingut cap problema: En l'enunciat reconec quina magnitud es fixa i aplicant-ho amb les formules, els exercicis ixen en cinc minuts.
4.8 Examen de prova de l'objectiu 4.
En la següent entrada publicaré l'examen amb els resultats.


No hay comentarios:
Publicar un comentario