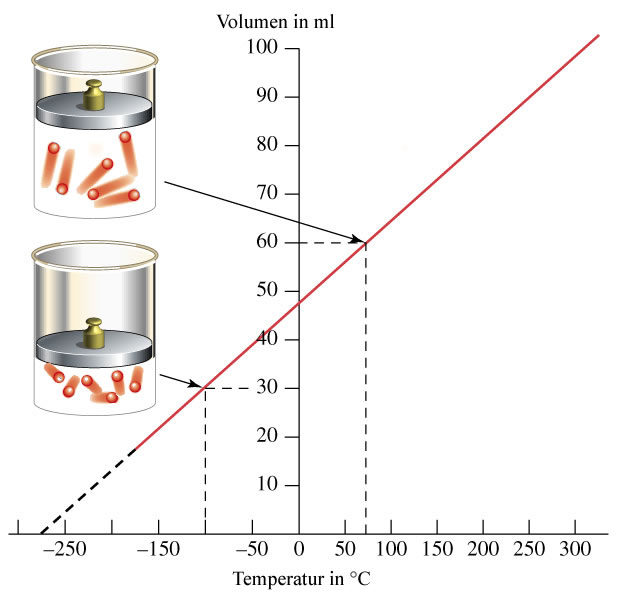
1. Enuncia la llei de Charles i justifica-la des del punt de vista de la teoria cinètica.
Llei de Charles
P=K
V1/T1=V2/T2
El volum i la temperatura quan la pressió es fixa el nombre de xocs contra les parets del recipient no varia perquè la pressió és constant.Si la temperatura puja i el volum augmenta, les partícules han d'anar més rapides per poder complir el seu nombre de xocs, si el volum disminueix les partícules hauran d'anar més lentes per tal de que el nombre de xocs siga el mateix que abans.
2. La següent gràfica és el resultat d'un experiment que s'ha fet amb un gas. A partir del que es veu en la gràfica contesta les preguntes següents:
a)Quina llei dels gasos s'ha intentat comprovar en l'experiment? Com ho saps.
La llei de Boyle per la forma dels resultats de la gràfica: el volum ha disminuït i la pressió augmentat.
b)Si suposes que l'experiment s'ajusta completament a la llei que s'intentava comprovar, cosa que mai passa perquè sempre hi ha errors, completa la taula següent de dades:
P(atm): 25 5 2'5 1'67 1'25 1 0'8^3 V(l): 1 5 10 15 20 25 30
c)En aquest experiment la pressió i el volum són magnituds directament proporcionals o inversament proporcionals? Justifica la teua resposta
Això es el que vol dir que són magnituds inversament proporcionals, quan una de les magnituds es multiplica per un número l'altra es divideix en la mateixa quantitat.
3. Es fa un experiment a temperatura constant de manera que un gas ocupa un volum de 11,3 l quan la pressió que exerceix sobre la parets del recipient és de 40 mmHg. Sense fer cap càlcul indica raonadament si el volum que ocuparà el gas serà major o menor quan la pressió és de 80mmHg. Raona la resposta.
El volum serà menor perquè si el recipient es més xicotet n'hi han més xocs i per això puja la pressió. Són inversament proporcionals com hem dit abans.
4. En el laboratori s'ha fet un experiment per comprovar una de les tres lleis dels gasos: la llei de Boyle, la llei de Charles o la llei de Gay-Lussac. Si només tens la gràfica que s'ha obtingut amb les dades de l'experiment, sense tindre les magnituds representades, a quina o quines de les tres lleis podria correspondre la gràfica següent? Raona la resposta.
Podria ser de la llei de Charles o de la llei de Gay-Lussac perquè les dos tenen magnituds proporcionals. I en cas de que el volum o la pressió (cada una de la seua llei) hauria pujat, la temperatura també. Podria ser també la llei de Boyle si es representa la pressió davant 1/V.
5. Es fa en el laboratori un experiment a volum constant i es mesura com varia la pressió que exerceix un gas sobre les parets del recipient respecte a la temperatura del gas. Es fa una primera mesura i s'obtenen uns valors determinats de la pressió i la temperatura. Si es torna a fer una nova mesura i s'obté que la temperatura, mesurada en K, és el doble de la que era al principi, indica raonadament que pots dir de la pressió respecte a la que es tenia inicialment.
Que la pressió ha pujat la mateixa quantitat que ho ha fet la temperatura (el doble) perquè són proporcionals.
La llei que s'utilitza en aquest experiment es la de Gay-Lussac i aquesta diu que si es multiplica la temperatura per un numero la pressió ha de ser multiplicada per el mateix, i en aquest cas ha segut per dos.
6. Un estudiant estava intentant demostrar si es complia la llei de Gay-Lussac en el laboratori i ha fet més d'un experiment amb gasos. Per mala sort totes les dades que tenia s'han mesclat i ha construït una taula de dades de manera que creu que totes aquestes dades corresponen a un experiment. Corresponen totes aquestes dades a un únic experiment o són de més d'un experiment? En cas de ser més d'un experiment, de quants experiments ha mesclat dades? Raona les respostes.
S'han mesclat dos experiments de Gay-Lussac. En aquesta llei n'hi han magnituds directament proporcionals encara que en la gràfica al comprovar si son proporcionals (dividint una magnitud per una altra) observem que certs valors coincideixen i altres també però no entre ells. Açò explica que pot ser els dos experiments estiguen ben fets però s'han mesclat les seues dades. Es fàcil identificar les diferències per poder separar-los.
7. Es fa un experiment en el laboratori en un recipient tancat, de manera que aquest recipient no es pot expandir-se ni es pot contraure. En un moment determinat es mesura la pressió del gas i és de 0,85 atm a una temperatura de 125 ºC. Després es torna a mesurar la pressió i es de 800 mmHg. Si es vol determinar la temperatura del gas per a aquesta última pressió, contesta les preguntes següents:
a) Quina llei dels gasos s'ha d'utilitzar per calcular la temperatura demanada? Justifica com ho saps a partir del que diu l'enunciat.
Llei de Gay-Lussac perquè es un recipient tancat no varia el volum.
b) Hi ha que fer canvis d'unitats abans de poder aplicar la llei dels gasos adient per resoldre l'exercici? En cas d'haver-se de fer canvis d'unitats indica la raó.
Sí, hi ha que fer canvis d'unitat en la pressió, que pot ser atm o mmHg i ho passem a alguna de les dos unitats i en la temperatura a graus kelvin.
c) Abans de resoldre l'exercici numèricament raona si la temperatura demanada serà major o menor de 125ºC.
Serà major perquè la pressió ha augmentat.
d) Calcula la temperatura quan la pressió és de 800 mmHg.
P1=0'85atm P2= 1'05atm
T1=398'15K T2= ???
T2= 398'15·1'05/0'85= 491'83K